https://kevesko.vn/20210809/thu-tuong-giam-thu-tuc-khi-cap-phep-vaccine-nanocovax-nhung-phai-dung-quy-dinh-10920774.html
Thủ tướng: Giảm thủ tục khi cấp phép vaccine Nanocovax nhưng phải đúng quy định
Thủ tướng: Giảm thủ tục khi cấp phép vaccine Nanocovax nhưng phải đúng quy định
Sputnik Việt Nam
Thủ tướng Phạm Minh Chính yêu cầu việc cấp phép và sử dụng vaccine Nanocovax cần giảm bớt quy trình, thủ tục hành chính, nhưng phải đảm bảo chặt chẽ theo quy... 09.08.2021, Sputnik Việt Nam
2021-08-09T18:59+0700
2021-08-09T18:59+0700
2021-08-09T18:59+0700
việt nam
xã hội
https://cdn.img.kevesko.vn/img/07e5/08/09/10920744_0:40:1687:993_1920x0_80_0_0_567dfaed472132acee9df5f5378a1d5b.jpg
Văn phòng Chính phủ nhận được văn bản ngày 1-8-2021 của GS-TS Nguyễn Gia Bình, Chủ tịch Hội Hồi sức cấp cứu và chống độc Việt Nam, Ủy viên Hội đồng chuyên môn Ban Bảo vệ chăm sóc sức khỏe Trung ương, kiến nghị về việc cấp phép sử dụng vắc-xin trong tình huống khẩn cấp.Về việc này, Thủ tướng Phạm Minh Chính yêu cầu Bộ trưởng Bộ Y tế nghiên cứu, chỉ đạo việc cấp phép và sử dụng vaccine Nanocovax theo hướng giảm bớt quy trình, thủ tục hành chính, nhưng phải đảm bảo chặt chẽ theo quy định và thẩm quyền.Hôm 6/8, Nanogen đã gửi báo cáo hỏa tốc tới Bộ Y tế, cho biết ước lượng vaccine Nanocovax có hiệu quả khoảng 90%, dựa trên các phân tích và so sánh trong thử nghiệm lâm sàng giai đoạn hai.Một ngày sau (7/8), Hội đồng đạo đức trong Nghiên cứu y sinh học, Bộ Y tế, họp đánh giá giữa kỳ, thẩm định kết quả thử nghiệm lâm sàng giai đoạn 2 của vaccine Nanocovax; đưa ra kết luận thống nhất nghiệm thu kết quả giai đoạn 1, đồng ý với báo cáo kết quả giữa kỳ giai đoạn 2 của nhóm nghiên cứu.Hội đồng đánh giá "vaccine Nanocovax an toàn, có khả năng sinh miễn dịch, chưa đánh giá hiệu lực bảo vệ vaccine".Vaccine phòng Covid-19 NanocovaxTrước đó, vaccine phòng Covid-19 Nanocovax được Công ty cổ phần Công nghệ sinh học dược Nanogen phát triển từ tháng 5-2020, dựa trên công nghệ protein tái tổ hợp. Vaccine này đã trải qua 2 giai đoạn thử nghiệm lâm sàng, trong đó giai đoạn 1 bắt đầu từ ngày 18-12-2020 và giai đoạn 2 từ ngày 26-2-2021.Theo TS Nguyễn Ngô Quang, Phó Cục trưởng Cục Khoa học, công nghệ và đào tạo (Bộ Y tế), vaccine Nanocovax của Công ty cổ phần Công nghệ sinh học dược Nanogen và Học viện Quân y nghiên cứu đang thử nghiệm lâm sàng giai đoạn 3 và đang thực hiện đánh giá 3 yếu tố, gồm tính an toàn, tính sinh miễn dịch, hiệu lực bảo vệ trên tình nguyện viên Việt Nam từ 18 tuổi trở lên.Trong đó, giai đoạn 3a tiêm cho 1.000 đối tượng, đánh giá giữa kỳ tính an toàn, tính sinh miễn dịch, tỉ lệ tiêm cho nhóm tình nguyện viên vắc-xin trên nhóm tiêm giả dược là 6:1. Giai đoạn 3b được tiêm trên 12.000 người, tỉ lệ tiêm cho nhóm tình nguyện viên vaccine trên nhóm tiêm giả dược là 2:1.Dự kiến, trước ngày 15-8 sẽ có đánh giá kết quả thử nghiệm lâm sàng giai đoạn 3a.Trên cơ sở này, các cơ quan liên quan sẽ rà soát để có dữ liệu ban đầu về tính sinh miễn dịch và hiệu lực bảo vệ của vắc-xin của giai đoạn 3a.
https://kevesko.vn/20210807/nanocovax-duoc-cho-phep-thu-nghiem-lam-sang-giai-doan-3-voi-muc-lieu-25-mcg-10915235.html
Sputnik Việt Nam
moderator.vn@sputniknews.com
+74956456601
MIA „Rossiya Segodnya“
2021
Sputnik Việt Nam
moderator.vn@sputniknews.com
+74956456601
MIA „Rossiya Segodnya“
tin thời sự
vn_VN
Sputnik Việt Nam
moderator.vn@sputniknews.com
+74956456601
MIA „Rossiya Segodnya“
Sputnik Việt Nam
moderator.vn@sputniknews.com
+74956456601
MIA „Rossiya Segodnya“
việt nam, xã hội
Thủ tướng: Giảm thủ tục khi cấp phép vaccine Nanocovax nhưng phải đúng quy định
Thủ tướng Phạm Minh Chính yêu cầu việc cấp phép và sử dụng vaccine Nanocovax cần giảm bớt quy trình, thủ tục hành chính, nhưng phải đảm bảo chặt chẽ theo quy định và thẩm quyền.
Văn phòng Chính phủ nhận được văn bản ngày 1-8-2021 của GS-TS Nguyễn Gia Bình, Chủ tịch Hội Hồi sức cấp cứu và chống độc Việt Nam, Ủy viên Hội đồng chuyên môn Ban Bảo vệ chăm sóc sức khỏe Trung ương, kiến nghị về việc cấp phép sử dụng vắc-xin trong tình huống khẩn cấp.
Về việc này, Thủ tướng Phạm Minh Chính yêu cầu Bộ trưởng Bộ Y tế nghiên cứu, chỉ đạo việc cấp phép và sử dụng vaccine Nanocovax theo hướng giảm bớt quy trình, thủ tục hành chính, nhưng phải đảm bảo chặt chẽ theo quy định và thẩm quyền.
Hôm 6/8, Nanogen đã gửi báo cáo hỏa tốc tới Bộ Y tế, cho biết ước lượng vaccine Nanocovax có hiệu quả khoảng 90%, dựa trên các phân tích và so sánh trong thử nghiệm lâm sàng giai đoạn hai.
Một ngày sau (7/8), Hội đồng đạo đức trong Nghiên cứu y sinh học, Bộ Y tế, họp đánh giá giữa kỳ, thẩm định kết quả thử nghiệm lâm sàng giai đoạn 2 của vaccine Nanocovax; đưa ra kết luận thống nhất nghiệm thu kết quả giai đoạn 1, đồng ý với báo cáo kết quả giữa kỳ giai đoạn 2 của nhóm nghiên cứu.
Hội đồng đánh giá "vaccine Nanocovax an toàn, có khả năng sinh miễn dịch, chưa đánh giá hiệu lực bảo vệ vaccine".
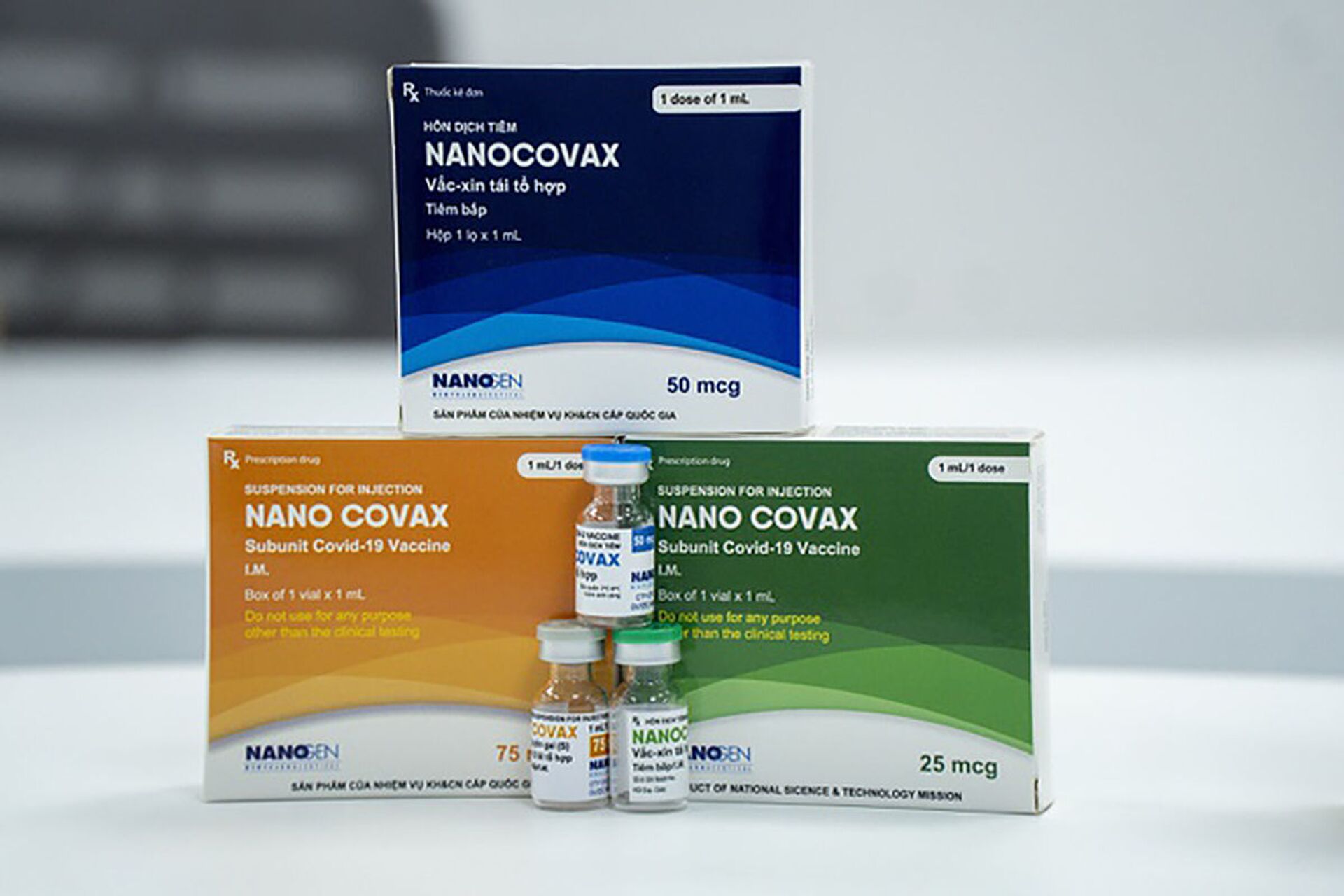
Vaccine phòng Covid-19 Nanocovax
Trước đó, vaccine phòng Covid-19 Nanocovax được Công ty cổ phần Công nghệ sinh học dược Nanogen phát triển từ tháng 5-2020, dựa trên công nghệ protein tái tổ hợp. Vaccine này đã trải qua 2 giai đoạn thử nghiệm lâm sàng, trong đó giai đoạn 1 bắt đầu từ ngày 18-12-2020 và giai đoạn 2 từ ngày 26-2-2021.
Theo TS Nguyễn Ngô Quang, Phó Cục trưởng Cục Khoa học, công nghệ và đào tạo (Bộ Y tế), vaccine Nanocovax của Công ty cổ phần Công nghệ sinh học dược Nanogen và Học viện Quân y nghiên cứu đang thử nghiệm lâm sàng giai đoạn 3 và đang thực hiện đánh giá 3 yếu tố, gồm tính an toàn, tính sinh miễn dịch, hiệu lực bảo vệ trên tình nguyện viên Việt Nam từ 18 tuổi trở lên.
Trong đó, giai đoạn 3a tiêm cho 1.000 đối tượng, đánh giá giữa kỳ tính an toàn, tính sinh miễn dịch, tỉ lệ tiêm cho nhóm tình nguyện viên vắc-xin trên nhóm tiêm giả dược là 6:1. Giai đoạn 3b được tiêm trên 12.000 người, tỉ lệ tiêm cho nhóm tình nguyện viên vaccine trên nhóm tiêm giả dược là 2:1.
Dự kiến, trước ngày 15-8 sẽ có đánh giá kết quả thử nghiệm lâm sàng giai đoạn 3a.
Trên cơ sở này, các cơ quan liên quan sẽ rà soát để có dữ liệu ban đầu về tính sinh miễn dịch và hiệu lực bảo vệ của vắc-xin của giai đoạn 3a.