https://kevesko.vn/20210827/nanocovax-do-viet-nam-san-xuat-hieu-qua-va-an-toan-den-dau-10997353.html
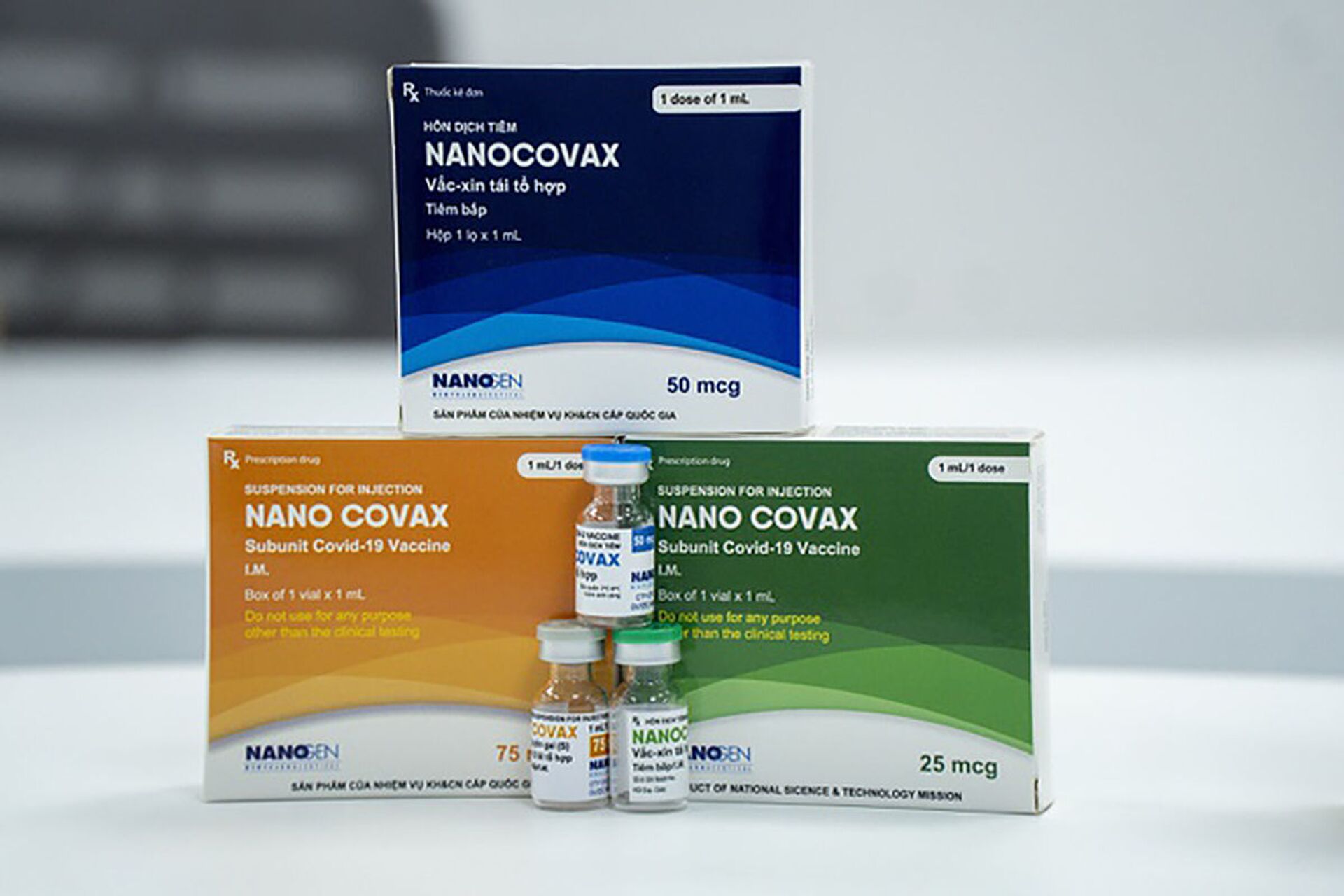
Nanocovax do Việt Nam sản xuất hiệu quả và an toàn đến đâu?
Nanocovax do Việt Nam sản xuất hiệu quả và an toàn đến đâu?
Sputnik Việt Nam
Hội đồng Đạo đức đã chấp thuận vaccine Nanocovax do Việt Nam nghiên cứu, thử nghiệm và sản xuất. Theo đó, kết quả thử nghiệm giữa kỳ giai đoạn 3a vaccine “made... 27.08.2021, Sputnik Việt Nam
2021-08-27T18:13+0700
2021-08-27T18:13+0700
2021-08-27T18:10+0700
việt nam
https://cdn.img.kevesko.vn/img/07e5/08/1b/10997695_0:107:2000:1232_1920x0_80_0_0_bd3a1fd984ac222e5eda79d993d0022d.jpg
Đồng thời, ngay sau khi được Hội đồng Đạo đức chấp thuận, toàn bộ hồ sơ, dữ liệu nghiên cứu vaccine Nanocovax sẽ được chuyển sang Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc của Bộ Y tế để ra quyết định cấp phép khẩn cấp có điều kiện với vaccine đầu tiên của Việt Nam.Hội đồng Đạo đức đã chấp thuận vaccine “made in Vietnam” NanocovaxMới đây, Hội đồng Đạo đức trong nghiên cứu y sinh quốc gia đã thông qua báo cáo thử nghiệm giữa kỳ giai đoạn 3 vaccine Nanocovax. Hồ sơ cấp phép lưu hành vaccine này được được cơ quan chức năng tiếp tục thẩm định.Theo đó, báo cáo này đã được Hội đồng Đạo đức trong nghiên cứu y sinh quốc gia thông qua hôm 22/8. Dù vậy, Hội đồng vẫn đề nghị yêu cầu chỉnh sửa báo cáo. Đến ngày 25/8, báo cáo chỉnh sửa được đệ trình lên hội đồng xem xét.Theo hướng dẫn mới nhất của Bộ Y tế (ban hành ngày 19/8), vaccine sản xuất trong nước có báo cáo giữa kỳ giai đoạn 3 được Hội đồng Đạo đức thông qua là đủ điều kiển để nộp hồ sơ xin phép lưu hành khẩn cấp.Bộ Y tế sẽ tiến hành lấy ý kiến của Hội đồng tư vấn cấp phép lưu hành thuốc và vaccine (Bộ Y tế), cũng như tham khảo hướng dẫn của Tổ chức Y tế thế giới.Một thành viên Hội đồng đạo đức cho biết, 3 ngày sau khi Hội đồng Đạo đức thông qua báo cáo, Hội đồng tư vấn cấp giấy phép thuốc và vaccine sẽ triệu tập họp để xem xét.Được biết, giai đoạn 3 thử nghiệm lâm sàng Nanocovax được thực hiện đa trung tâm, đảm bảo tính ngẫu nhiên, có đối chứng giả dược, nhằm đánh giá tính an toàn, khả năng sinh miễn dịch và hiệu quả bảo vệ của vaccine trong phòng Covid-19 trên 13.000 tình nguyện viên từ 18 tuổi trở lên.Đáng chú ý, theo một số nguồn tin, hiệu quả của Nanocovax có thể còn ngang ngửa với nhiều vaccine khác trên thế giới hiện nay, với Delta vaccine “made in Vietnam” đạt khoảng 75%.Nanocovax của Việt Nam hiệu quả và an toàn ra sao?Có tất cả 13.000 người được tiêm trong giai đoạn 3a và 3b. Hội đồng Đạo đức đã đánh giá giữa kỳ giai đoạn 3a với 1.000 người đã tiêm 2 mũi. Báo cáo cho thấy, chỉ 2 trường hợp có phản ứng phản vệ độ 2 (đều hồi phục).Những tình nguyện viên còn lại gặp một số phản ứng như đau vết tiêm, ngứa, sưng nổi cục tại vị trí tiêm, buồn nôn, một số có sốt nhẹ.Cụ thể, phía đơn vị nghiên cứu cho thấy, theo kết quả thu thập từ 856 người tiêm mũi và 824 người tiêm mũi 2 cho thấy có một trường hợp đau nặng tại chỗ tiêm (chiếm 0,1%), tỷ lệ đau nhẹ sau tiêm mũi 1 và mũi 2 lần lượt là 38,7% và 44,7%. Tỷ lệ này ở giả dược dao động 37-42%.Hai trường hợp ngứa trung bình sau tiêm mũi 2, tỷ lệ ngứa mức độ nhẹ khi tiêm mũi 1 là 46 trường hợp (5,4%), mũi 2 là 83 trường hợp (10,1%). Ở nhóm tiêm giả dược dao động 3,6-5,5%.Báo cáo cũng cho thấy, có một trường hợp bị sưng cục cứng nặng sau tiêm mũi 2. Hai trường hợp nổi cục cứng mức độ trung bình.Ngoài ra, tỷ lệ buồn nôn mức độ nhẹ sau tiêm 2 mũi Nano Covax là 1,8%, mức độ nặng là 0,1%. Tỷ lệ đau cơ mức nhẹ sau tiêm 2 mũi vaccine dao động 6,3-11,4%. Tỷ lệ ở nhóm giả dược là 4,1-13%; đau cơ mức độ nặng dao động 0,4-0,6%.Khoảng 12-14% tình nguyện viên bị đau đầu mức độ nhẹ sau tiêm vaccine; mức độ nặng chiếm 0,8-1,1%. Ở nhóm giả dược, tỷ lệ đau đầu nhẹ từ 13,8-15,9% và 0,7% đau trung bình.Khoảng 20-25% tình nguyện viên bị mệt mỏi mức độ nhẹ sau tiêm vaccine. Tỷ lệ này ở nhóm giả dược 23-29%; mệt mỏi mức độ trung bình khá thấp, dao động 1,2-1,9% so với 0,7-2,9% ở nhóm giả dược.Theo báo cáo, có 29 trường hợp bị tiêu chảy mức độ nhẹ sau tiêm vaccine mũi 1 và 27 trường hợp sau tiêm mũi 2, chiếm tỷ lệ lần lượt 3,4% và 3,3%. Hai trường hợp bị tiêu chảy mức độ trung bình.Ngoài ra, tỷ lệ bị sốt sau tiêm vaccine khá thấp, dao động 2,3-3,7% bị sốt nhẹ, 0,2% sốt trung bình, 0,1% sốt nặng. Ở nhóm giả dược, nhóm sốt nhẹ dao động 1,4-4,8%.Cũng theo báo cáo, 14 trường hợp gặp biến cố bất lợi trong quá trình tham gia thử nghiệm. Tuy nhiên, 11 trường hợp không liên quan đến vaccine.Trong giai đoạn 3a, khả năng trung hoà virus sống của vaccine Nano Covax tại thời điểm ngày thứ 42 (tức 14 ngày sau tiêm mũi 2) là 96,5%.Trung bình nhân hiệu giá kháng thể PRNT50 với chủng Vũ Hán là 63,5 trong khi ở nhóm giả dược là 5.Kết quả nghiên cứu cho thấy, trung bình nhân nồng độ kháng thể Anti-S-IgG đạt 57.56 U/ml, tăng gấp 218.93 lần so với D0 (thời điểm trước tiêm). Tỷ lệ chuyển đảo huyết thanh đạt 99,2%. Vaccine đảm bảo yêu cầu về tính an toàn và sinh miễn dịch.Nhóm nghiên cứu đề xuất tiếp tục thực hiện giai đoạn 3b, đảm bảo an toàn và đúng tiến độ với 12.000 người tham gia, đồng thời đề xuất cấp phép khẩn cấp có điều kiện cho vaccine Nanocovax.Việc cấp phép cho Nanocovax phụ thuộc vào những yếu tố nào?Nanocovax là 1 trong 2 vaccine nội địa của Việt Nam và là vaccine có tiến độ phát triển nhanh nhất. Nhà sản xuất Nanogen cho biết vaccine có giá 120.000 đồng/mũi tiêm và có thể cung cấp 100 triệu liều trong năm 2021.Nếu sản phẩm vaccine này được cấp phép, đây sẽ là cột mốc quan trọng trong hành trình chống dịch ở Việt Nam, đưa đất nước tự chủ về vaccine. Tính đến ngày 27/8, Việt Nam đã nhận được 27 triệu liều vaccine và mới sử dụng gần 19 triệu liều.PGS.TS Lê Văn Truyền, Chủ tịch Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc của Bộ Y tế cho hay, để được cấp phép, Hội đồng Đạo đức phải có biên bản nghiệm thu các kết quả thử nghiệm và nghiên cứu vaccine Nanocovax.Bên cạnh đó, Công ty Nanogen cần nộp toàn bộ hồ sơ đăng ký lưu hành vaccine Nanocovax cho Cục Quản lý Dược của Bộ Y tế.Về quá trình cấp phép khẩn cấp vaccine Nanocovax của Nanogen, TS. Nguyễn Hữu Huân - Giám đốc Khoa học Công ty IGY Life Sciences, giáo sư kiêm nhiệm Đại học Arizona, là chuyên gia đang sống tại Mỹ với 27 năm nghiên cứu vaccine và miễn dịch chống virus, từng nghiên cứu khoa học về vaccine chống cúm và SARS chia sẻ với Viettimes nhiều nội dung đáng chú ý.Theo vị chuyên gia, ông chưa nắm số liệu về kết quả thử nghiệm các giai đoạn, tính an toàn, tính sinh miễn dịch, hiệu quả bảo vệ của vaccine do Việt Nam nghiên cứu, tuy vậy, Nanocovax đã được thông qua giai đoạn 1, 2, thử giai đoạn 3 cho thấy, vaccine an toàn và sinh miễn dịch tốt.Ở giai đoạn 3, vaccine sẽ tiếp tục được đánh giá an toàn và sinh miễn dịch ở số người được tiêm lớn hơn và đánh giá hiệu quả bảo vệ. TS. Nguyễn Hữu Huân phân tích, để có được kết quả bảo vệ có ý nghĩa về thống kê, giai đoạn 3 phụ thuộc rất nhiều vào số lượng những người bị mắc Covid-19 trong cộng đồng.Thông tin về quá trình cấp phép khẩn cấp vaccine Covid-19, TS. Nguyễn Hữu Huân cho hay, ở Hoa Kỳ, tất cả phải trải qua đủ các giai đoạn như xét duyệt các vaccine bình thường khác.Chuyên gia lưu ý thêm, việc xem xét sử dụng khẩn cấp vaccine chỉ khác ở điểm linh động duy nhất trong giai đoạn 3 là họ không chờ có được dữ liệu đầy đủ như quy trình thông thường, mà xin ý kiến của một hội đồng chuyên gia độc lập để đánh giá và bỏ phiếu.Nhận định về khả năng cấp phép sớm cho Nanocovax của Việt Nam, sau khi đã kết thúc quá trình thử nghiệm lâm sàng giai đoạn 3, chuyên gia Nguyễn Hữu Huân cho hay, ông không nắm số liệu. Đồng thời, kể cả có số liệu giai đoạn 3a thì cũng không đủ số liệu để đạt kết quả có ý nghĩa về mặt thống kê.Bình luận về vaccine “made in Vietnam” này, TS. Nguyễn Hữu Huân cho rằng, vaccine của Việt Nam là “an toàn”, “hiệu quả”.Mặc dù vậy, theo ông hay dựa trên cách đánh giá của FDA Mỹ thì, yếu tố quan trọng nhất để vaccine Nanocovax được cấp phép sử dụng khẩn cấp là đánh giá của Hội đồng các chuyên gia có bề dầy trong lĩnh vực vaccine và các chế phẩm sinh học liên quan đến vaccine.Chuyên gia chỉ rõ, Hội đồng sẽ đánh giá ý nghĩa của số liệu có được và cân nhắc giữa rủi ro và lợi ích.Cấp phép trong vòng 20 ngày?Thông tư 11 Hướng dẫn đăng ký lưu hành vaccine phòng Covid-19 trong trường hợp cấp bách được Bộ Y tế ban hành ngày 19/8 cho thấy, vaccine đủ tiêu chuẩn cấp phép khẩn cấp có điều kiện khi đang thử nghiệm lâm sàng và đã có kết quả giữa kỳ pha 3 về tính an toàn và hiệu quả bảo vệ của vaccine dựa trên dữ liệu về tính sinh miễn dịch của vaccine.Đồng thời, việc cấp phép sẽ dựa trên ý kiến tư vấn của Hội đồng đạo đức trong nghiên cứu y sinh học cấp quốc gia và ý kiến tư vấn của Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc, có tham khảo hướng dẫn hoặc khuyến cáo của Tổ chức Y tế thế giới (WHO).Đáng chú ý, theo Thông tư, trong thời hạn tối đa 20 ngày làm việc kể từ ngày nhận đủ hồ sơ đối với hồ sơ đề nghị cấp giấy đăng ký lưu hành vaccine, Cục trưởng Cục Quản lý Dược sẽ cấp giấy đăng ký lưu hành vaccine.Trong trường hợp vaccine đã được cấp giấy đăng ký lưu hành nhưng cần đánh giá thêm về an toàn, hiệu quả, trên cơ sở ý kiến tư vấn của Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc, vaccine có thể yêu cầu thử nghiệm lâm sàng giai đoạn 4 tại Việt Nam.Tính đến nay, phía công ty Nanogen và nhóm nghiên cứu đã nhiều lần đề nghị xin cấp phép khẩn cấp có điều kiện cho vaccine Nanocovax. Tuy nhiên, dựa trên tôn chỉ chặt chẽ, khoa học, đặt tính mạng, sức khoẻ người dân lên hàng đầu, Bộ Y tế yêu cầu nhà sản xuất hoàn thiện bộ dữ liệu để các hội đồng chuyên môn đánh giá tổng thể, khách quan và chính xác nhất.Như Sputnik thông tin, trước đó đã có nhiều tỉnh cũng xin được tiêm thử nghiệm vaccine Nanocovax diện rộng trong bối cảnh số ca mắc Covid-19 tăng nhanh, tuy nhiên Bộ Y tế chưa đồng ý.Quan điểm mà Bộ Y tế đưa ra chính là việc mở rộng địa bàn nghiên cứu cần đảm bảo an toàn, khoa học, khả thi, tuân thủ đạo đức nghiên cứu. Hồ sơ nghiên cứu phải được xây dựng và đệ trình Bộ Y tế phê duyệt sau khi Hội đồng Đạo đức trong nghiên cứu y sinh học quốc gia thẩm định và chấp thuận.Đối với Bộ Y tế, tất cả phải đặt yếu tố an toàn, sức khỏe, tính mạng của người dân cao hơn tất cả mọi yếu tố lợi ích kinh tế khác.
https://kevesko.vn/20210809/thu-tuong-giam-thu-tuc-khi-cap-phep-vaccine-nanocovax-nhung-phai-dung-quy-dinh-10920774.html
https://kevesko.vn/20210807/nanocovax-duoc-cho-phep-thu-nghiem-lam-sang-giai-doan-3-voi-muc-lieu-25-mcg-10915235.html
https://kevesko.vn/20210806/thong-tin-bat-ngo-ve-hieu-qua-cua-vaccine-nanocovax-do-viet-nam-san-xuat-10912400.html
https://kevesko.vn/20210802/khong-ai-tu-vong-sau-tiem-nanocovax-vingroup-tang-thuoc-dieu-tri-covid-19-remdesivir-10889160.html
https://kevesko.vn/20210729/vingroup-xay-nha-may-san-xuat-vaccine-nanocovax-cua-viet-nam-co-the-som-duoc-cap-phep-10874039.html
https://kevesko.vn/20210719/do-an-toan-cua-vaccine-do-viet-nam-san-xuat-nanocovax-ra-sao-10830446.html
https://kevesko.vn/20210625/bo-y-te-tang-toc-do-thu-nghiem-nanocovax-tren-13000-nguoi-10716256.html
Sputnik Việt Nam
moderator.vn@sputniknews.com
+74956456601
MIA „Rossiya Segodnya“
2021
Thu Nguyễn
https://cdn.img.kevesko.vn/img/07e5/03/0f/10219522_382:0:2430:2048_100x100_80_0_0_43bc86120fb9231e4e6caed7b17391d0.jpg
Thu Nguyễn
https://cdn.img.kevesko.vn/img/07e5/03/0f/10219522_382:0:2430:2048_100x100_80_0_0_43bc86120fb9231e4e6caed7b17391d0.jpg
tin thời sự
vn_VN
Sputnik Việt Nam
moderator.vn@sputniknews.com
+74956456601
MIA „Rossiya Segodnya“
Sputnik Việt Nam
moderator.vn@sputniknews.com
+74956456601
MIA „Rossiya Segodnya“
Thu Nguyễn
https://cdn.img.kevesko.vn/img/07e5/03/0f/10219522_382:0:2430:2048_100x100_80_0_0_43bc86120fb9231e4e6caed7b17391d0.jpg
việt nam
Đồng thời, ngay sau khi được Hội đồng Đạo đức chấp thuận, toàn bộ hồ sơ, dữ liệu nghiên cứu vaccine Nanocovax sẽ được chuyển sang Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc của Bộ Y tế để ra quyết định cấp phép khẩn cấp có điều kiện với vaccine đầu tiên của Việt Nam.
Hội đồng Đạo đức đã chấp thuận vaccine “made in Vietnam” Nanocovax
Mới đây, Hội đồng Đạo đức trong nghiên cứu y sinh quốc gia đã thông qua báo cáo thử nghiệm giữa kỳ giai đoạn 3 vaccine Nanocovax. Hồ sơ cấp phép lưu hành vaccine này được được cơ quan chức năng tiếp tục thẩm định.
Theo đó, báo cáo này đã được Hội đồng Đạo đức trong nghiên cứu y sinh quốc gia thông qua hôm 22/8. Dù vậy, Hội đồng vẫn đề nghị yêu cầu chỉnh sửa báo cáo. Đến ngày 25/8, báo cáo chỉnh sửa được đệ trình lên hội đồng xem xét.
Theo hướng dẫn mới nhất của
Bộ Y tế (ban hành ngày 19/8), vaccine sản xuất trong nước có báo cáo giữa kỳ giai đoạn 3 được Hội đồng Đạo đức thông qua là đủ điều kiển để nộp hồ sơ xin phép lưu hành khẩn cấp.
Bộ Y tế sẽ tiến hành lấy ý kiến của Hội đồng tư vấn cấp phép lưu hành thuốc và vaccine (Bộ Y tế), cũng như tham khảo hướng dẫn của Tổ chức Y tế thế giới.
Một thành viên Hội đồng đạo đức cho biết, 3 ngày sau khi Hội đồng Đạo đức thông qua báo cáo, Hội đồng tư vấn cấp giấy phép thuốc và vaccine sẽ triệu tập họp để xem xét.
Được biết, giai đoạn 3 thử nghiệm lâm sàng Nanocovax được thực hiện đa trung tâm, đảm bảo tính ngẫu nhiên, có đối chứng giả dược, nhằm đánh giá tính an toàn, khả năng sinh miễn dịch và hiệu quả bảo vệ của vaccine trong phòng Covid-19 trên 13.000 tình nguyện viên từ 18 tuổi trở lên.
Đáng chú ý, theo một số nguồn tin, hiệu quả của Nanocovax có thể còn ngang ngửa với nhiều vaccine khác trên thế giới hiện nay, với Delta
vaccine “made in Vietnam” đạt khoảng 75%.
Nanocovax của Việt Nam hiệu quả và an toàn ra sao?
Có tất cả 13.000 người được tiêm trong giai đoạn 3a và 3b. Hội đồng Đạo đức đã đánh giá giữa kỳ giai đoạn 3a với 1.000 người đã tiêm 2 mũi. Báo cáo cho thấy, chỉ 2 trường hợp có phản ứng phản vệ độ 2 (đều hồi phục).
Những tình nguyện viên còn lại gặp một số phản ứng như đau vết tiêm, ngứa, sưng nổi cục tại vị trí tiêm, buồn nôn, một số có sốt nhẹ.
Cụ thể, phía đơn vị nghiên cứu cho thấy, theo kết quả thu thập từ 856 người tiêm mũi và 824 người tiêm mũi 2 cho thấy có một trường hợp đau nặng tại chỗ tiêm (chiếm 0,1%), tỷ lệ đau nhẹ sau tiêm mũi 1 và mũi 2 lần lượt là 38,7% và 44,7%. Tỷ lệ này ở giả dược dao động 37-42%.
Hai trường hợp ngứa trung bình sau tiêm mũi 2, tỷ lệ ngứa mức độ nhẹ khi tiêm mũi 1 là 46 trường hợp (5,4%), mũi 2 là 83 trường hợp (10,1%). Ở nhóm tiêm giả dược dao động 3,6-5,5%.
Báo cáo cũng cho thấy, có một trường hợp bị sưng cục cứng nặng sau tiêm mũi 2. Hai trường hợp nổi cục cứng mức độ trung bình.
Ngoài ra, tỷ lệ buồn nôn mức độ nhẹ sau tiêm 2 mũi Nano Covax là 1,8%, mức độ nặng là 0,1%. Tỷ lệ đau cơ mức nhẹ sau tiêm 2 mũi vaccine dao động 6,3-11,4%. Tỷ lệ ở nhóm giả dược là 4,1-13%; đau cơ mức độ nặng dao động 0,4-0,6%.
Khoảng 12-14% tình nguyện viên bị đau đầu mức độ nhẹ sau tiêm vaccine; mức độ nặng chiếm 0,8-1,1%. Ở nhóm giả dược, tỷ lệ đau đầu nhẹ từ 13,8-15,9% và 0,7% đau trung bình.
Khoảng 20-25% tình nguyện viên bị mệt mỏi mức độ nhẹ sau tiêm vaccine. Tỷ lệ này ở nhóm giả dược 23-29%; mệt mỏi mức độ trung bình khá thấp, dao động 1,2-1,9% so với 0,7-2,9% ở nhóm giả dược.
Theo báo cáo, có 29 trường hợp bị tiêu chảy mức độ nhẹ sau tiêm vaccine mũi 1 và 27 trường hợp sau tiêm mũi 2, chiếm tỷ lệ lần lượt 3,4% và 3,3%. Hai trường hợp bị tiêu chảy mức độ trung bình.
Ngoài ra, tỷ lệ bị sốt sau
tiêm vaccine khá thấp, dao động 2,3-3,7% bị sốt nhẹ, 0,2% sốt trung bình, 0,1% sốt nặng. Ở nhóm giả dược, nhóm sốt nhẹ dao động 1,4-4,8%.
Cũng theo báo cáo, 14 trường hợp gặp biến cố bất lợi trong quá trình tham gia thử nghiệm. Tuy nhiên, 11 trường hợp không liên quan đến vaccine.
Trong giai đoạn 3a, khả năng trung hoà virus sống của vaccine Nano Covax tại thời điểm ngày thứ 42 (tức 14 ngày sau tiêm mũi 2) là 96,5%.
Trung bình nhân hiệu giá kháng thể PRNT50 với chủng Vũ Hán là 63,5 trong khi ở nhóm giả dược là 5.
Kết quả nghiên cứu cho thấy, trung bình nhân nồng độ kháng thể Anti-S-IgG đạt 57.56 U/ml, tăng gấp 218.93 lần so với D0 (thời điểm trước tiêm). Tỷ lệ chuyển đảo huyết thanh đạt 99,2%. Vaccine đảm bảo yêu cầu về tính an toàn và sinh miễn dịch.
Nhóm nghiên cứu đề xuất tiếp tục thực hiện giai đoạn 3b, đảm bảo an toàn và đúng tiến độ với 12.000 người tham gia, đồng thời đề xuất cấp phép khẩn cấp có điều kiện cho vaccine Nanocovax.
Việc cấp phép cho Nanocovax phụ thuộc vào những yếu tố nào?
Nanocovax là 1 trong 2 vaccine nội địa của Việt Nam và là vaccine có tiến độ phát triển nhanh nhất. Nhà sản xuất
Nanogen cho biết vaccine có giá 120.000 đồng/mũi tiêm và có thể cung cấp 100 triệu liều trong năm 2021.
Nếu sản phẩm vaccine này được cấp phép, đây sẽ là cột mốc quan trọng trong hành trình chống dịch ở Việt Nam, đưa đất nước tự chủ về vaccine. Tính đến ngày 27/8, Việt Nam đã nhận được 27 triệu liều vaccine và mới sử dụng gần 19 triệu liều.
PGS.TS Lê Văn Truyền, Chủ tịch Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc của Bộ Y tế cho hay, để được cấp phép, Hội đồng Đạo đức phải có biên bản nghiệm thu các kết quả thử nghiệm và nghiên cứu vaccine Nanocovax.
Bên cạnh đó, Công ty Nanogen cần nộp toàn bộ hồ sơ đăng ký lưu hành vaccine Nanocovax cho Cục Quản lý Dược của Bộ Y tế.
Về quá trình cấp phép khẩn cấp vaccine Nanocovax của Nanogen, TS. Nguyễn Hữu Huân - Giám đốc Khoa học Công ty IGY Life Sciences, giáo sư kiêm nhiệm Đại học Arizona, là chuyên gia đang sống tại Mỹ với 27 năm nghiên cứu vaccine và miễn dịch chống virus, từng nghiên cứu khoa học về vaccine chống cúm và SARS chia sẻ với Viettimes nhiều nội dung đáng chú ý.
Theo vị chuyên gia, ông chưa nắm số liệu về kết quả thử nghiệm các giai đoạn, tính an toàn, tính sinh miễn dịch, hiệu quả bảo vệ của vaccine do Việt Nam nghiên cứu, tuy vậy, Nanocovax đã được thông qua giai đoạn 1, 2, thử giai đoạn 3 cho thấy, vaccine an toàn và sinh miễn dịch tốt.
Ở giai đoạn 3, vaccine sẽ tiếp tục được đánh giá an toàn và sinh miễn dịch ở số người được tiêm lớn hơn và đánh giá hiệu quả bảo vệ. TS. Nguyễn Hữu Huân phân tích, để có được kết quả bảo vệ có ý nghĩa về thống kê, giai đoạn 3 phụ thuộc rất nhiều vào số lượng những người bị mắc Covid-19 trong cộng đồng.
“Tuy số ca bị nhiễm SARS-CoV-2 ở Việt Nam tăng so với trước đây nhưng chưa phải cao để sớm có đủ số liệu cho giai đoạn 3”, ông Huân lưu ý.
Thông tin về quá trình cấp phép khẩn cấp vaccine Covid-19, TS. Nguyễn Hữu Huân cho hay, ở Hoa Kỳ, tất cả phải trải qua đủ các giai đoạn như xét duyệt các vaccine bình thường khác.
Chuyên gia lưu ý thêm, việc xem xét sử dụng khẩn cấp vaccine chỉ khác ở điểm linh động duy nhất trong giai đoạn 3 là họ không chờ có được dữ liệu đầy đủ như quy trình thông thường, mà xin ý kiến của một hội đồng chuyên gia độc lập để đánh giá và bỏ phiếu.
“Dựa trên số liệu có được tại thời điểm xét duyệt “khẩn cấp”. Khi xét duyệt sử dụng khẩn cấp có lựa chọn vừa sử dụng vừa đánh giá”, TS. Nguyễn Hữu Huân nói.
Nhận định về khả năng cấp phép sớm cho Nanocovax của Việt Nam, sau khi đã kết thúc quá trình thử nghiệm lâm sàng giai đoạn 3, chuyên gia Nguyễn Hữu Huân cho hay, ông không nắm số liệu. Đồng thời, kể cả có số liệu giai đoạn 3a thì cũng không đủ số liệu để đạt kết quả có ý nghĩa về mặt thống kê.
“Trong tình trạng khẩn cấp như hiện nay, việc vừa cho phép sử dụng khẩn cấp vừa tiếp tục thử nghiệm là lựa chọn tốt”, chuyên gia lưu ý.
Bình luận về vaccine “made in Vietnam” này, TS. Nguyễn Hữu Huân cho rằng, vaccine của Việt Nam là “an toàn”, “hiệu quả”.
“Về cơ sở khoa học và dựa trên những thử nghiệm lâm sàng các vaccine phòng Covid-19 đang được lưu hành, ô vaccine phòng Covid-19 Nanocovax an toàn và hiệu quả. Về việc bao lâu vaccine phòng Covid-19 Nanocovax được cấp phép sử dụng khẩn cấp thì còn phụ thuộc vào nhiều yếu tố”, ông Huân nói.
Mặc dù vậy, theo ông hay dựa trên cách đánh giá của FDA Mỹ thì, yếu tố quan trọng nhất để vaccine Nanocovax được cấp phép sử dụng khẩn cấp là đánh giá của Hội đồng các chuyên gia có bề dầy trong lĩnh vực vaccine và các chế phẩm sinh học liên quan đến vaccine.
Chuyên gia chỉ rõ, Hội đồng sẽ đánh giá ý nghĩa của số liệu có được và cân nhắc giữa rủi ro và lợi ích.
Cấp phép trong vòng 20 ngày?
Thông tư 11 Hướng dẫn đăng ký lưu hành vaccine phòng Covid-19 trong trường hợp cấp bách được Bộ Y tế ban hành ngày 19/8 cho thấy, vaccine đủ tiêu chuẩn cấp phép khẩn cấp có điều kiện khi đang thử nghiệm lâm sàng và đã có kết quả giữa kỳ pha 3 về tính an toàn và hiệu quả bảo vệ của vaccine dựa trên dữ liệu về tính sinh miễn dịch của vaccine.
Đồng thời, việc cấp phép sẽ dựa trên ý kiến tư vấn của Hội đồng đạo đức trong nghiên cứu y sinh học cấp quốc gia và ý kiến tư vấn của Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc, có tham khảo hướng dẫn hoặc khuyến cáo của
Tổ chức Y tế thế giới (WHO).
Đáng chú ý, theo Thông tư, trong thời hạn tối đa 20 ngày làm việc kể từ ngày nhận đủ hồ sơ đối với hồ sơ đề nghị cấp giấy đăng ký lưu hành vaccine, Cục trưởng Cục Quản lý Dược sẽ cấp giấy đăng ký lưu hành vaccine.
“Sau khi được cấp phép lưu hành, cơ sở đăng ký phải tiếp tục phối hợp với cơ sở sản xuất thực hiện nghiên cứu lâm sàng và cập nhật dữ liệu lâm sàng theo hướng dẫn của Bộ Y tế”, Thông tư nêu rõ.
Trong trường hợp vaccine đã được cấp giấy đăng ký lưu hành nhưng cần đánh giá thêm về an toàn, hiệu quả, trên cơ sở ý kiến tư vấn của Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc, vaccine có thể yêu cầu thử nghiệm lâm sàng giai đoạn 4 tại Việt Nam.
Tính đến nay, phía công ty Nanogen và nhóm nghiên cứu đã nhiều lần đề nghị xin cấp phép khẩn cấp có điều kiện cho vaccine Nanocovax. Tuy nhiên, dựa trên tôn chỉ chặt chẽ, khoa học, đặt tính mạng, sức khoẻ người dân lên hàng đầu, Bộ Y tế yêu cầu nhà sản xuất hoàn thiện bộ dữ liệu để các hội đồng chuyên môn đánh giá tổng thể, khách quan và chính xác nhất.
Như Sputnik thông tin, trước đó đã có nhiều tỉnh cũng xin được tiêm thử nghiệm vaccine Nanocovax diện rộng trong bối cảnh số ca mắc Covid-19 tăng nhanh, tuy nhiên Bộ Y tế chưa đồng ý.
Quan điểm mà Bộ Y tế đưa ra chính là việc mở rộng địa bàn nghiên cứu cần đảm bảo an toàn, khoa học, khả thi, tuân thủ đạo đức nghiên cứu. Hồ sơ nghiên cứu phải được xây dựng và đệ trình Bộ Y tế phê duyệt sau khi Hội đồng Đạo đức trong nghiên cứu y sinh học quốc gia thẩm định và chấp thuận.
Đối với Bộ Y tế, tất cả phải đặt yếu tố an toàn, sức khỏe, tính mạng của người dân cao hơn tất cả mọi yếu tố lợi ích kinh tế khác.